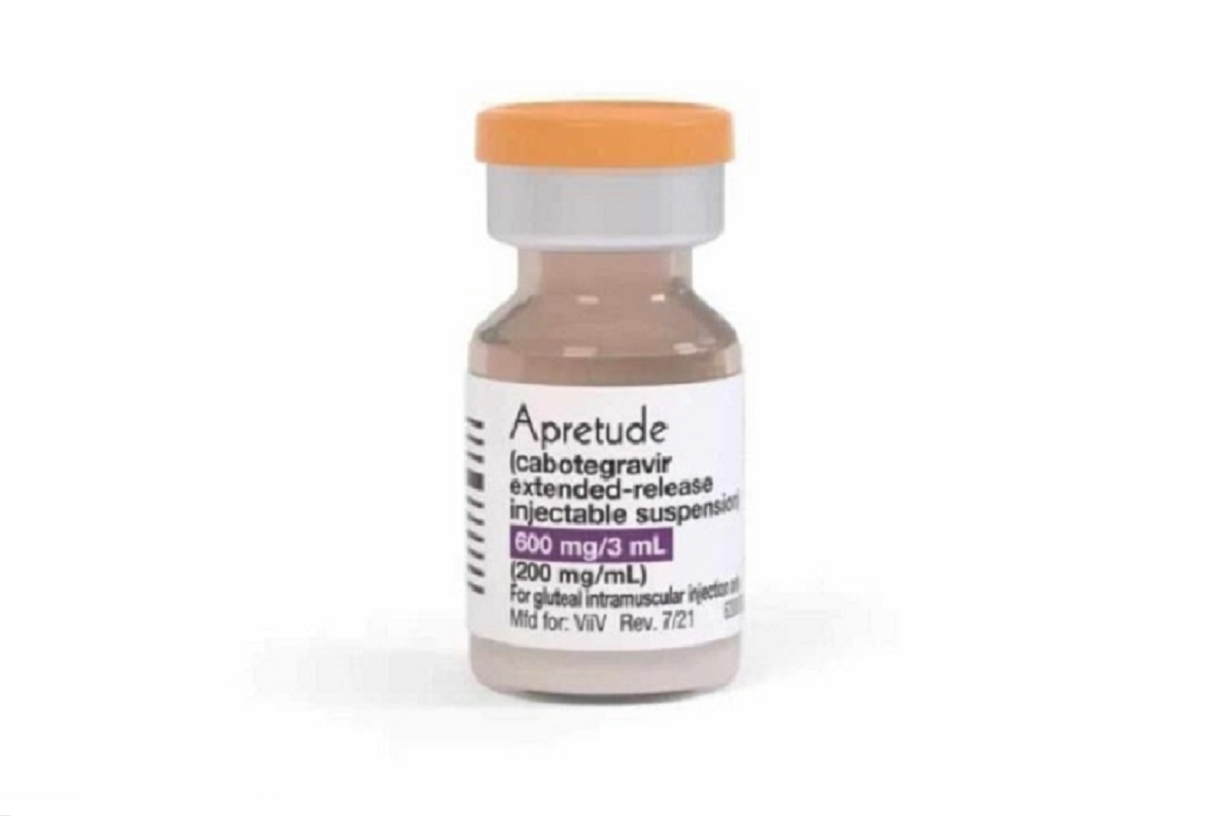
A Anvisa (Agência Nacional de Vigilância Sanitária) aprovou uma nova PrEP (profilaxia pré-exposição) contra o HIV, vírus causador da Aids. Trata-se de uma PrEP injetável, administrada com intervalos de dois meses. Ela usa um medicamento chamado cabotegravir.
O diferencial do método está na praticidade: a PrEP disponível atualmente no país, e oferecida gratuitamente pelo SUS (Sistema Único de Saúde), é administrada via oral e deve ser tomada todos os dias. Os comprimidos, porém, são uma combinação de dois remédios: tenofovir e entricitabina.
A nova PrEP é uma alternativa de médio e longo prazo – o que, segundo especialistas, pode aumentar a adesão. As duas primeiras injeções intramusculares do antirretroviral são aplicadas no glúteo do usuário com quatro semanas de intervalo. Depois, a cada 2 meses.
Pessoas acima de 35 kg podem usar o medicamento injetável. Isso possibilita a adoção por adolescentes, grupo com baixa adesão aos comprimidos da PrEP oral.
O registro da PrEP injetável apareceu no DOU (Diário Oficial da União) de 5 de junho, e a Anvisa deu autorização à farmacêutica britânica GSK (GlaxoSmithKline).
Isso não significa que a PrEP injetável já estará disponível pelo SUS. A aprovação do permite que pessoas interessadas em usar o cabotegravir comprem o medicamento no sistema privado de saúde, por exemplo. Mas ainda não há uma data para o início da venda no Brasil.
A oferta do medicamento no SUS, aliás, ainda é uma incógnita. O Ministério da Saúde ainda deve negociar o preço do medicamento com a farmacêutica britânica. Depois, avaliar a viabilidade da incorporação do cabotegravir no sistema público de saúde. Só então começa o processo de incorporação. Mas a aprovação pela Anvisa é, claro, um primeiro passo importante.
Estudos sobre o medicamento
Em 2022, a OMS (Organização Mundial da Saúde) recomendou que os países oferecessem o cabotegravir para prevenção contra eventuais infecções pelo vírus causador da Aids. No mesmo ano, a Fiocruz (Fundação Oswaldo Cruz) anunciou um estudo para avaliar a viabilidade de implementação do remédio no SUS.
O estudo, que deve durar dois anos, será realizado em centros de pesquisa do Rio de Janeiro, São Paulo, Campinas, Florianópolis, Salvador e Manaus. Trata-se de uma colaboração da Fundação com a organização de inovação em saúde Unitaid e o Ministério da Saúde. O cabotegravir do estudo é doado pela GSK.
A pesquisa da Fiocruz e a aprovação pela Anvisa acontecem depois de dois ensaios clínicos de fase 3, que avaliam a eficácia de um medicamento antes de seu registro por órgãos regulatórios. O primeiro aconteceu em 43 centros de pesquisa em sete países, incluindo nas cidades do Rio de Janeiro, São Paulo e Porto Alegre. O segundo, em países da África subsaariana.
Os estudos avaliaram o uso da PrEP injetável (cabotegravir) em comparação à PrEP administrada via oral (tenofovir e entricitabina), primeiro entre homens cisgênero e mulheres transgênero; depois em mulheres cisgênero. Ambas as pesquisas mostraram que as injeções eram mais eficazes para a prevenção do HIV.
A responsável pelos ensaios clínicos de fase 3 foi a rede de pesquisa HPTN (HIV Prevention Trials Network) com financiamento do Instituto Nacional de Alergia e Doenças Infecciosas do NIH (National Institutes of Health), agência dos Estados Unidos responsável por pesquisas nas áreas de biomedicina e saúde pública.
Custos do cabotegravir
Até então, a PrEP injetável havia sido aprovada e disponibilizada em países da África subsaariana, como a África do Sul e o Zimbábue, na Austrália e nos Estados Unidos. A FDA (a Anvisa americana) aprovou o cabotegravir em 2021, e por lá um ano de injeções custa cerca de US$ 22 mil (R$ 110 mil).
O preço é um obstáculo à adesão da profilaxia em alguns locais. Um estudo de custo-benefício mostrou que, na África do Sul, a PrEP injetável deveria custar entre 60 e 119 dólares ao ano. Os pesquisadores também estimaram que 42 mil infecções pelo HIV seriam evitadas até 2028 se um terço dos homens jovens e 60% das mulheres jovens do país usassem as injeções.
Em julho de 2022, a GSK anunciou o licenciamento voluntário da patente do cabotegravir com a Medicines Patent Pool. Isso permitiu que 90 países considerados de renda baixa ou média-baixa – como todos os países africanos com exceção da Líbia – pudessem comprar versões genéricas do medicamento. O Brasil, que abrigou ensaios clínicos do cabotegravir, ficou de fora.