Luciana Constantino, da Agência FAPESP
Amplamente usado no Sistema Único de Saúde (SUS) contra diversos tipos de câncer, entre eles mama, pulmão e ovário, o paclitaxel é um quimioterápico que apresenta vários efeitos colaterais. A lista inclui dores, fraqueza e até falta de ar. Há casos em que se torna necessário suspender o tratamento. O mecanismo por trás das reações adversas ainda não está claro, mas uma pesquisa recentemente divulgada revela um alvo a ser investigado.
O estudo publicado na revista Cell Death & Disease mostra que a droga se liga e ativa o receptor celular C5aR1, envolvido em doenças inflamatórias e tumores. Essa conexão é crucial para a origem das reações adversas do quimioterápico, principalmente a chamada neuropatia periférica. Ela ocorre quando há mau funcionamento da comunicação dos nervos periféricos com o cérebro, provocando dores, formigamento, dificuldade de movimento e perda muscular, por exemplo.
O resultado do trabalho aponta um caminho para novos estudos avançarem na busca de um alvo farmacológico, visando prevenir essas reações.
“Mostramos que a molécula do fármaco é capaz de ativar vias de sinalização específicas, no caso as do receptor C5aR1, e isso está ligado aos efeitos adversos. Se entendemos o que está por trás desse processo e dissociamos do efeito antiproliferativo do quimioterápico, podemos encontrar um alvo para diminuir e até bloquear as reações colaterais”, diz um dos autores do artigo, o professor Thiago Mattar Cunha, do Centro de Pesquisa em Doenças Inflamatórias (CRID) – um Centro de Pesquisa, Inovação e Difusão (CEPID) da FAPESP sediado na Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo (FMRP-USP).
O artigo contou com a participação da cientista Andreza Urba de Quadros, do CRID, que também recebeu apoio da FAPESP, e de pesquisadores da empresa italiana Dompé Farmaceutici S.p.A., incluindo o autor correspondente Marcello Allegetti.
Segundo Cunha, a publicação é resultado do esforço conjunto dos pesquisadores e de anos de trabalho. “Nosso grupo vem estudando o receptor C5aR1 desde os anos 2000 e já em 2008 demonstramos seu papel na dor inflamatória. Desde essa época, viemos aprofundando as investigações. No caminho, houve a parceria com a Dompé”, conta o professor à Agência FAPESP.
Etapas
A partir de estudos anteriores, em que ficou demonstrado o papel de uma citocina, a interleucina (IL)-8, nos efeitos adversos induzidos por paclitaxel em tratamentos contra cânceres (toxicidade neuronal), os cientistas procuraram proteínas que ativam a expressão de IL-8.
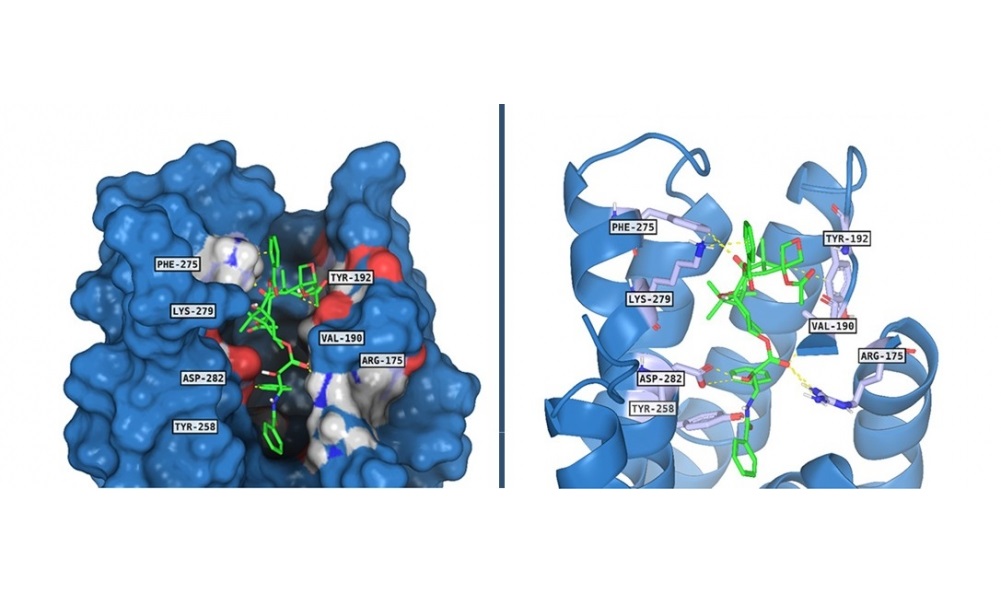
Para isso, usaram a plataforma de supercomputação Exscalate e fizeram simulações de ancoragem molecular – método que prevê a orientação preferencial de uma molécula a uma segunda, mostrando o complexo formado quando as duas se ligam. Por meio dessas simulações, foi possível chegar à alta afinidade de C5aR1 com paclitaxel.
O C5aR1 funciona como receptores do complemento, conjunto de proteínas que fazem parte do sistema imune inato (o primeiro a entrar em ação quando há uma ameaça, iniciando a resposta de defesa). A ativação desses receptores contribui para regular a resposta inflamatória. Embora a relevância de C5aR1 em dores pareça consolidada, ainda há várias partes a serem descobertas do quebra-cabeça envolvido nos mecanismos pelos quais o receptor participa desse processo.
Na validação da previsão feita por meio do computador (in silico), o grupo utilizou o sistema de ressonância plasmon de superfície. O receptor foi imobilizado sobre um sensor, enquanto o paclitaxel fluiu por meio dele e houve a interação.
Durante a fase da pesquisa in vitro, os cientistas confirmaram a natureza específica da ligação C5aR1-paclitaxel em uma linhagem de neurônios (camundongos). E descobriram que ela desencadeia dentro da célula nervosa uma via de sinalização, a NFkB/P38 e c-Fos, envolvida na ativação de IL-8.
Em células neuronais e gânglios de ratos, a inibição de C5aR1 protegeu contra os efeitos neuropatológicos induzidos pelo quimioterápico, enquanto em camundongos tratados com paclitaxel a ausência ou inibição do receptor melhorou significativamente os sintomas das reações adversas induzidas pela quimioterapia.
Por fim, a pesquisa mostrou que a inibição de C5aR1 pode neutralizar a liberação de citocinas anafiláticas (que podem desencadear reações alérgicas) induzidas por paclitaxel em macrófagos in vitro, bem como o aparecimento de reações de hipersensibilidade em camundongos.
“Os próximos passos envolvem ensaios clínicos usando drogas que bloqueiam o C5aR1, já disponíveis no mercado, e talvez anticorpos, que são mais caros. Mas antes temos de pesquisar o quanto essa via pode modular a atividade do paclitaxel no tumor e se desativá-la prejudica ou não o efeito do medicamento”, explica Cunha, que é especialista em dor e inflamação.
Em 2020, o professor venceu o Patrick D. Wall Young Investigator Award for Basic Science, promovido pela Associação Internacional para o Estudo da Dor (IASP, na sigla em inglês). Entregue de dois em dois anos desde 1985, o prêmio é destinado a cientistas de até 40 anos que alcançaram alto nível de excelência e liderança em pesquisas sobre dor (leia mais em: agencia.fapesp.br/32327/).
O artigo Paclitaxel binds and activates C5aR1: a new potential therapeutic target for the prevention of chemotherapy-induced peripheral neuropathy and hypersensitivity reactions pode ser lido em: www.nature.com/articles/s41419-022-04964-w.