
Mecanismo que freia resposta do sistema imune agrava a malária
Texto: Renata Fontanetto/Revista Pesquisa Fapesp
Os principais sintomas da malária – febre, cansaço, mal-estar e dores pelo corpo – costumam aparecer de 10 a 15 dias depois de o parasita causador da doença, o protozoário do gênero Plasmodium, ser injetado no corpo pela picada de uma fêmea de mosquito Anopheles infectada. Crianças, gestantes, portadores do vírus HIV e pessoas que nunca tiveram contato com o patógeno correm risco mais alto de desenvolver a forma mais grave da doença, que causa 600 mil mortes por ano no mundo – quase todas (95%) na África. Um estudo liderado por pesquisadores brasileiros e publicado em fevereiro na revista Cell Metabolism elucida um mecanismo de autorregulação que, na malária, evita uma resposta exagerada do sistema imune. Ao fazer isso, o sistema de defesa evita danos ao corpo humano, mas favorece a multiplicação do protozoário e, com ela, o agravamento da doença.
Em experimentos com um modelo animal que simula a malária humana, a equipe do imunologista Ricardo Gazzinelli, da Universidade Federal de Minas Gerais (UFMG) e da Fundação Oswaldo Cruz (Fiocruz), verificou que a segunda fase de ativação do sistema imune, na qual o organismo se prepara para agir com força total contra o invasor, não funciona como o esperado. Na malária, um sinal químico que induz o amadurecimento das células dendríticas, responsáveis por amplificar a resposta imunológica recrutando mais componentes da defesa contra o invasor, causa o efeito oposto ao desejado. Em vez de preparar as células dendríticas para recrutar outras com ação específica contra o parasita, esse sinal desorganiza o funcionamento dessas células e freia a resposta imune. O resultado? O protozoário ganha tempo para se reproduzir sem ser perturbado, intensificando os sintomas da malária.
“Essa alteração na atividade das células dendríticas é uma forma de autorregulação imunológica”, explica Gazzinelli, que também é professor na Universidade de Massachusetts, nos Estados Unidos, onde parte dos experimentos foi realizada com apoio da FAPESP. “Ela evita a hiperativação do sistema imune, que pode ser danosa para o indivíduo. Isso protege o organismo do hospedeiro, mas favorece a multiplicação do parasita.”
Assim como nas infecções por vírus ou bactérias, também na malária o sinal de amplificação da resposta imunológica é dado por uma proteína chamada interferon-gama, um mensageiro químico produzido por determinadas células de defesa expostas ao invasor no início da infecção. Liberado pelas células natural killers e pelos linfócitos T que tiveram contato com o parasita na primeira onda da resposta imune, o interferon-gama dispara no baço a fase seguinte do combate. Nesse órgão com o tamanho de um punho, que integra o sistema imune e fica na parte superior esquerda do abdômen, o sinalizador estimula células de defesa em repouso (os monócitos) a se transformarem em células dendríticas, que eventualmente envolvem o parasita, despedaçam-no e apresentam esses fragmentos para outro grupo de linfócitos, os T CD8+. Estes, por sua vez, acionam outros componentes do sistema de defesa capazes de destruir as células infectadas. Isso, claro, quando tudo sai como o imaginado.
Só que na malária parece ocorrer algo diferente, constatou a bióloga Theresa Ramalho. Durante um estágio de pós-doutorado realizado em Massachusetts sob a supervisão de Gazzinelli, ela infectou camundongos com Plasmodium chabaudi, uma espécie que causa malária em roedores, e analisou o comportamento das células dendríticas do baço.
Ramalho observou que o interferon-gama desorganiza o funcionamento dessas células. Inicialmente, o sinalizador induz algo previsível e até desejável em células que desempenham uma atividade intensa: um aumento no consumo de glicose, a principal fonte de energia.
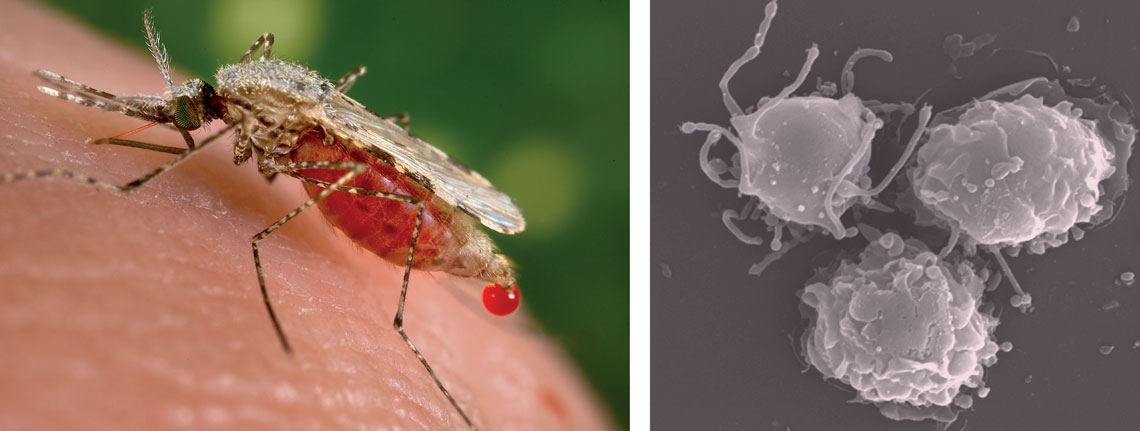
Fêmea de Anopheles stephensi, um dos transmissores da malária, e células dendríticas, cujo funcionamento está alterado na doença, vistas ao microscópio eletrônico. Imagem: Jim Gathany / CDC | Laboratório de Ricardo Gazzinelli / UFMG
O problema é que, na malária, o ciclo de transformação da glicose em energia não se completa. Nas células dendríticas, o interferon-gama estimula a produção de uma proteína que interrompe o processo no meio do caminho. Essa proteína, a enzima aconitato desidrogenase1 (Acod1), impede que a digestão da glicose seja concluída e transforma o açúcar parcialmente digerido em itaconato, um composto que passa a se acumular nessas células e impede o funcionamento das mitocôndrias, as centrais energéticas. “Nas células dendríticas dos roedores infectados, os níveis de itaconato estavam 35 vezes mais elevados que o normal. No sangue, quatro vezes mais”, conta Ramalho, primeira autora do estudo.
Capaz de impedir o crescimento de bactérias, o itaconato não tem o mesmo efeito microbicida contra protozoários, organismos também formados por uma só célula, mas mais complexos. O aumento dos níveis de itaconato nas mitocôndrias danifica essas organelas e dispara uma sequência de fenômenos nas células dendríticas que as impedem de ativar os linfócitos T CD8+. “O parasita se aproveita dessa situação e se multiplica mais”, explica a bióloga.
Testes com roedores geneticamente alterados para não produzir Acod1 – e não acumular itaconato – mostraram que a ausência dessa enzima foi suficiente para restabelecer o acionamento dos linfócitos T CD8+. “Sem o itaconato, os camundongos combateram melhor a infecção e a quantidade de plasmódio no sangue foi menor”, relata a pesquisadora.
O acúmulo de itaconato observado nesse modelo experimental de malária parece ocorrer também na doença humana. Os pesquisadores verificaram que, em pessoas infectadas com Plasmodium falciparum, predominante no continente africano e causador da forma mais letal de malária, as células dendríticas produziam mais Acod1. Algo semelhante foi constatado na infecção por Plasmodium vivax, o mais comum fora da África, em geral associado a uma enfermidade mais branda. Os níveis de itaconato estavam mais elevados no sangue de pessoas infectadas com essa espécie do parasita.
Especialistas em malária que não participaram do estudo afirmam que os achados são promissores e podem ajudar na formulação de novas terapias contra o plasmódio. “Tanto o itaconato quanto a enzima Acod1 podem virar alvo de possíveis intervenções clínicas”, afirma a bióloga Cristiana de Brito, da Fiocruz. Na sua avaliação, o itaconato pode ainda se tornar um marcador da doença. “Medir seus níveis no sangue talvez permita identificar as pessoas com maior risco de evoluir para um quadro grave de malária”, explica.
A biomédica Silvia Boscardin, da Universidade de São Paulo (USP), compartilha da mesma visão. Para ela, o trabalho traz indícios convincentes de que o itaconato pode desempenhar um papel imunossupressor também nos seres humanos. “Isso cria a possibilidade de testar, quando disponíveis para uso clínico, eventuais medicamentos que reduzam o acúmulo desse composto para avaliar se poderiam melhorar a condição clínica dos pacientes”, afirma.
Projeto
Mecanismos imunológicos de resistência e patogênese da malária (nº 16/23618-8); Modalidade Projeto Temático; Pesquisador responsável João Santana da Silva (USP-RP); Investimento R$ 7.350.121,64.
Artigo científico
RAMALHO, T. et al. Itaconate impairs immune control of Plasmodium by enhancing mtDNA-mediated PD-L1 expression in monocyte-derived dendritic cells. Cell Metabolism. 6 fev. 2024.









