Órgão de vigilância dos EUA diz que vacina da Pfizer não apresenta efeitos colaterais graves
Hoje tivemos a primeira análise substancial de dados sobre uma das vacinas contra COVID-19 que provavelmente chegará ao público geral dos EUA no final deste mês. A Food and Drug Administration (FDA) e as empresas Pfizer e BioNTech divulgaram a documentação resumida dos dados de ensaio coletados até agora sobre a candidata. Os extensos materiais, entre outras coisas, oferecem uma prévia de como seria tomar as duas injeções.
Os documentos foram divulgados ao público antes de uma reunião crucial que acontecerá na quinta-feira (10), quando um comitê consultivo de especialistas externos avaliará e discutirá os dados dos testes antes de recomendar (ou não) a autorização de uso emergencial.
Os documentos das empresas resumem o que elas planejam apresentar ao comitê, enquanto a documentação da FDA corresponde à revisão dos dados pela agência. Juntos, eles representam a primeira análise real dos resultados da Pfizer/BioNTech além de um comunicado de imprensa corporativo.
Há muitas informações otimistas. Os dados dos ensaios de fase 3 realizados até agora, por exemplo, sugerem que a primeira dose da vacina pode fornecer uma quantidade substancial de imunidade dentro de duas a três semanas. Um gráfico ilustrativo (visto abaixo) mostra que o risco de infecção sintomática cai significativamente no grupo tratado com vacina em comparação ao grupo de controle que recebeu o placebo após a primeira dose. Claro, é somente após a segunda dose, administrada um mês depois, que a vacina parece atingir a eficácia de aproximadamente 95% vista nos dados gerais.
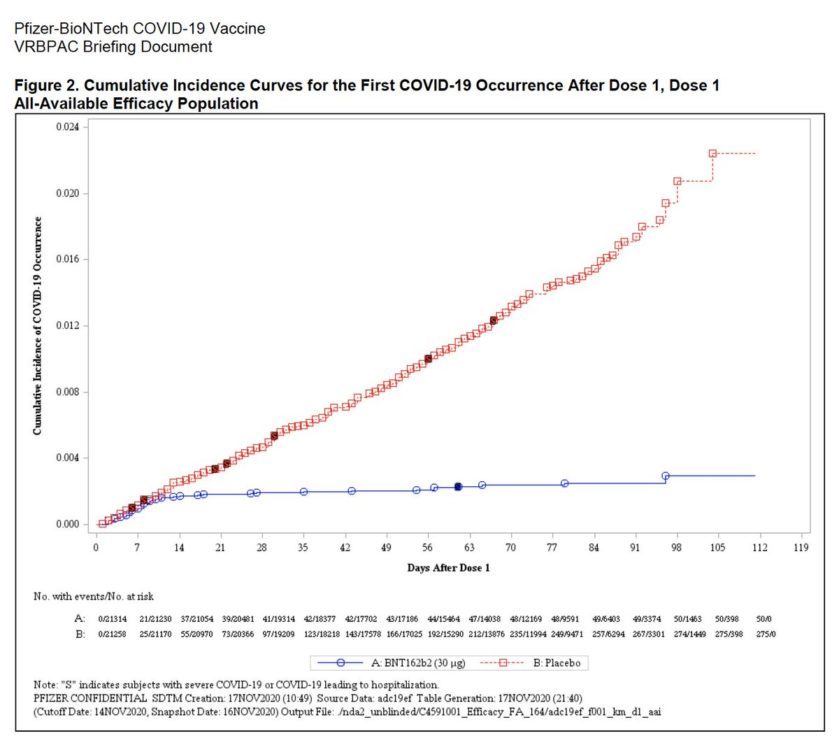 O risco de contrair COVID-19 parece cair significativamente em voluntários vacinados após tomar uma dose da vacina candidata da Pfizer/BioNTech, de acordo com os dados apresentados pelas duas empresas. Foto: Pfizer/BioNTech
O risco de contrair COVID-19 parece cair significativamente em voluntários vacinados após tomar uma dose da vacina candidata da Pfizer/BioNTech, de acordo com os dados apresentados pelas duas empresas. Foto: Pfizer/BioNTech
Os dados de segurança parecem tranquilizadores. Quando cientistas ou agências de saúde desejam avaliar a segurança de um novo tratamento ou vacina em um ensaio clínico, eles procuram por eventos adversos, que são simplesmente problemas médicos que acontecem durante os testes. Esses problemas podem ou não ter sido causados pelo medicamento em estudo. Se algum evento adverso for mais comum no grupo de tratamento do que no grupo de controle, é mais provável que seja um efeito colateral do tratamento.
De acordo com a revisão da FDA, não houve eventos adversos graves ou com risco de vida relacionados à administração da vacina entre 38.000 participantes e nenhuma “preocupação de segurança específica identificada que impediria a emissão de uma autorização de uso emergencial”.
Dito isso, vale ressaltar que não existe nenhum medicamento que não tenha efeitos colaterais. A expectativa é que, quanto mais soubermos sobre o que esperar, menor a chance de ficarmos apavorados ao apresentarmos reações após a injeção ou de atribuirmos erroneamente os efeitos colaterais à doença real — você já deve ter ouvido alguém dizer que ficou gripado por tomar a vacina da gripe, por exemplo.
Os dados de segurança vêm de 38.000 voluntários que receberam duas doses e foram monitorados por pelo menos dois meses (outra análise feita com 5.000 voluntários extras posteriormente no estudo não encontrou diferenças significativas).
Esses são os dados detalhados:
- 84,1% tiveram reações no local da injeção, como dor ou coceira nos sete dias após a primeira e/ou segunda dose.
- 62,9% tiveram fadiga.
- 55,1% tiveram dor de cabeça.
- 38,3% sentiram dores musculares.
- 31,9% tiveram calafrios.
- 23,6% tiveram dores nas articulações.
- 14,2% tiveram febre.
Em outras palavras, muitas pessoas experimentaram sintomas semelhantes aos de uma gripe.
Esses sintomas geralmente duravam alguns dias no máximo, e menos de 5% dos voluntários desenvolveram uma reação adversa considerada intensa, como uma dor de cabeça latejante, mas nada que colocasse a vida em risco.
Curiosamente, os jovens eram mais propensos a experimentar uma reação adversa intensa do que as pessoas com mais de 55 anos. Mas, por outro lado, não havia nenhuma diferença perceptível no perfil de segurança da vacina em relação à idade, sexo ou raça e etnia. Pessoas de 16 a 17 anos — ainda consideradas crianças — tomaram a vacina também, e os dados limitados até agora sugerem que é tão seguro para eles quanto para os adultos.
Porém, ainda há questões de longo prazo que levarão tempo para serem respondidas para qualquer vacina que chegue ao público.
Ainda nesta quarta-feira (9), June Raine, chefe executiva do órgão regulador Medicines and Healthcare products Regulatory Agency (MHRA) do Reino Unido, alertou o comitê parlamentar sobre dois indivíduos que apresentaram uma reação alérgica à vacina da Pfizer logo após receberem a dose. Ambos eram funcionários do NHS, sistema de saúde universal do Reino Unido, e tinham histórico de alergias graves e portavam canetas de adrenalina.
A Pfizer afirmou que vai investigar os casos em parceria com a BioNTech, além de alterar as diretrizes da vacina. Por enquanto, o MHRA determinou que pessoas com histórico de alergias não devem receber a vacina. Segundo declaração do Professor Stephen Powis, diretor médico do NHS na Inglaterra, os dois pacientes estão se recuperando bem. Ele ainda reforçou que reações alérgicas são comuns em casos de novas vacinas.
Mesmo com a análise da FDA, não está claro se a vacina candidata da Pfizer/BioNTech ou a vacina da Moderna são eficazes na prevenção da transmissão do coronavírus como um todo, ou se as pessoas vacinadas ainda podem carregar o vírus silenciosamente se expostas e transmiti-lo a outras pessoas não vacinadas. É importante saber isso, porque a transmissão assintomática ainda pode ser um risco real no futuro previsível, pelo menos até que um número suficiente da população seja vacinada.
Também não sabemos quanto tempo durará essa imunidade fornecida pela vacina, embora haja motivos para otimismo.
Existem outras lacunas a serem preenchidas nos dados. Por exemplo, não sabemos como as mulheres grávidas responderiam à vacina, porque elas não foram estudadas (um problema de longa data na pesquisa de ensaios clínicos). Portanto, elas não terão acesso a nenhuma vacina, e isso pode ser apenas no início ou se estender para sempre.
As crianças mais novas agora estão sendo estudadas em testes de vacinas, incluindo os da Pfizer/BioNTech, mas levará algum tempo para que os dados de segurança apareçam, então elas também estarão por último na lista para receber a vacina.
Uma nota de rodapé interessante diz respeito a pessoas que já haviam contraído COVID-19, mas receberam a vacina mesmo assim. De acordo com a FDA, uma análise secundária sugere que a vacina tem benefícios na prevenção de COVID-19 entre indivíduos previamente infectados com o coronavírus, “embora os dados disponíveis para esses resultados não permitissem conclusões precisas”. Sabemos que a reinfecção pode ocorrer, embora pareça ser rara.
Em geral, parecem boas notícias. E quase certamente saberemos se a primeira vacina contra COVID-19 será aprovada nos Estados Unidos até o final da semana.
Atualizado em 09/12, às 16:00, para incluir informações sobre os dois pacientes que desenvolveram reações alérgicas no Reino Unido.