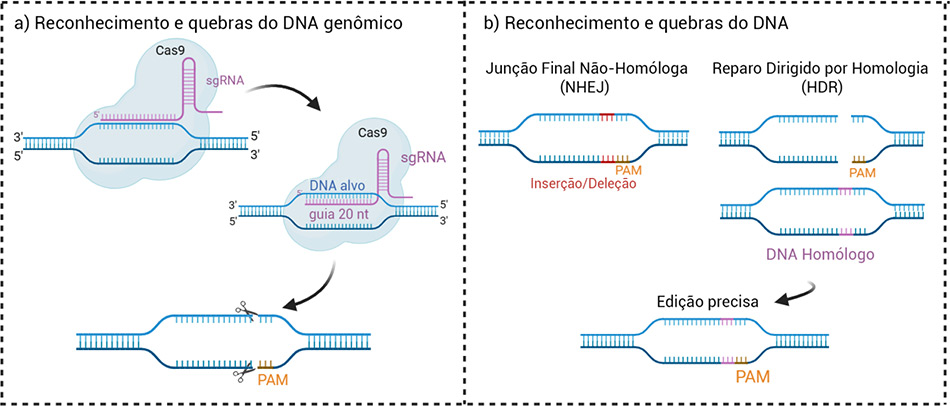
“O processo de reparo celular pode então ser direcionado para correções ou inserir novas sequências de DNA”, descrevem os pesquisadores. “A edição pode ocorrer por meio de dois mecanismos principais de reparo: a especificidade de extremidades não homólogas [não semelhantes entre si], que pode introduzir lesões de perda de função, ou o reparo dirigido por homologia, que permite a inserção de uma nova sequência de DNA no local cortado”, descrevem os pesquisadores.
“A CRISPR-Cas9 apresenta diversas aplicações potenciais, incluindo terapia gênica para correção de mutações genéticas em doenças hereditárias, modificação de células imunes em tratamentos oncológicos e combate a doenças infecciosas como HIV e HTLV-1 para eliminar DNA viral de células hospedeiras”, ressaltam os pesquisadores. “Além disso, é amplamente usado na criação de modelos de doenças e no melhoramento genético de plantas, promovendo resistência a pragas e aumento de produtividade. Em biotecnologia, CRISPR-Cas9 otimiza a produção industrial de biofármacos e biocombustíveis, com potencial futuro de prevenir doenças hereditárias em embriões.”
Segundo os pesquisadores, os estudos sobre o uso da edição dos genes CRISPR-Cas9 para deter a infecção pelo HTLV-1 estão em projetos iniciais, com foco principalmente em experimentos in vitro e em modelos celulares testados em laboratório. “As pesquisas têm explorado a capacidade do CRISPR-Cas9 para interromper a integração do HTLV-1 no genoma de células hospedeiras ou para desativar genes virais essenciais”, relatam. “Além disso, a dificuldade em desenvolver métodos de entrega do sistema CRISPR-Cas9 em células-alvo específicas, como células T infectadas, e a ausência de ensaios clínicos robustos [com grande número de pacientes] ainda limitam o avanço para aplicações clínicas.”
“Pesquisas futuras focam no desenvolvimento de técnicas que aumentem a eficiência e a precisão da edição genética, como o desenho de novos gRNAs [sequências de RNA que guiam o corte do DNA no processo de edição] e a utilização de métodos de entrega mais eficientes”, observam Domingues, Folgosi e Casseb. “Portanto, embora os estudos estejam avançando, ainda são necessários maiores progressos para que o CRISPR-Cas9 seja aplicado como uma terapia viável contra o HTLV-1.”
O estudo foi desenvolvido no IMT, sob a supervisão do professor Jorge Casseb. A pesquisa conta ainda com a colaboração da professora Shirley Komninakis, da Universidade Federal de São Paulo (Unifesp), do Núcleo de Apoio à Pesquisa em Retrovírus, sediado na FMUSP e cujo site pode ser acessado aqui, e da professora Simone Kashima, do Centro de Terapia Celular (CTC) da USP, com sede no Hemocentro de Ribeirão Preto, além de pós-graduandos da USP e Unifesp. O artigo de revisão Novel approaches for HTLV-1 therapy: innovative applications of CRISPR-Cas9 foi publicado na Revista do Instituto de Medicina Tropical de São Paulo no último dia 24 de agosto.
Mais informações: e-mails wildomingues@alumni.usp.br, com Wilson Domingues, e jcasseb@usp.br, com o professor Jorge Casseb