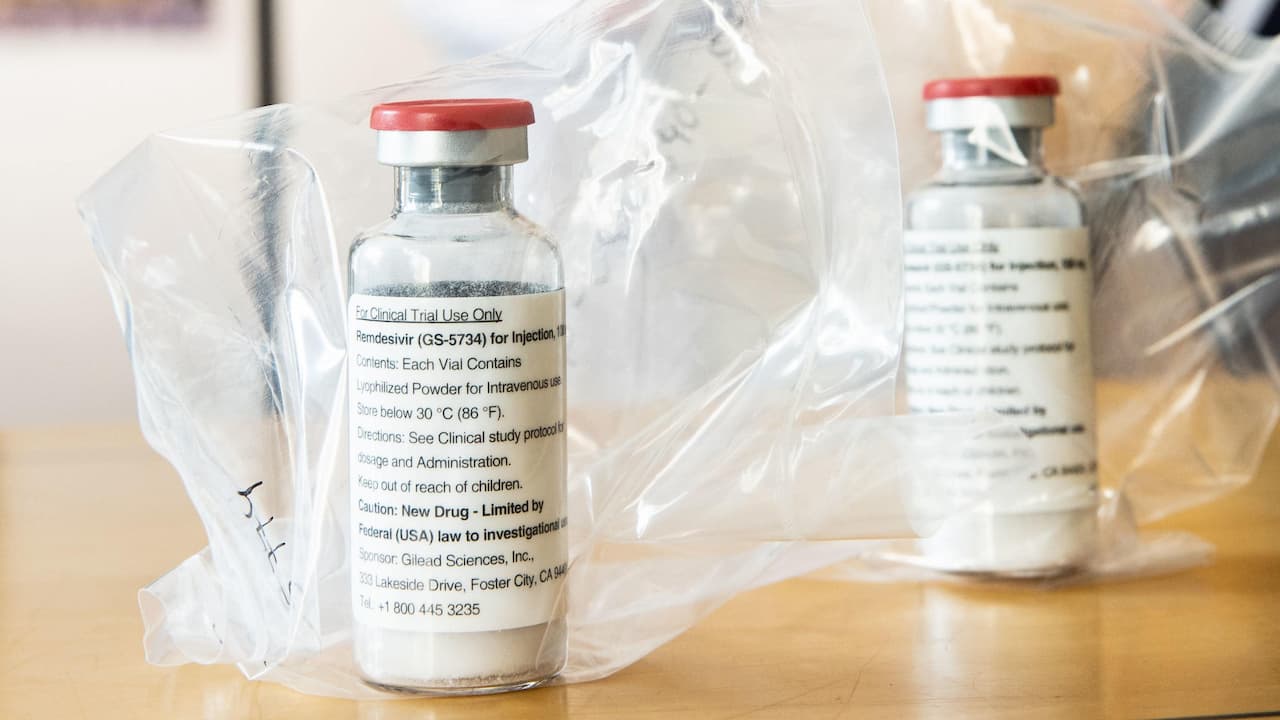
A FDA (Food and Drug Administration), órgão americano que autoriza medicamentos no país, aprovou o remdesivir para tratar pacientes hospitalizados com COVID-19. O antiviral, que é fabricado e comercializado pela farmacêutica Gilead sob a marca Veklury, é o primeiro a ser aprovado para o tratamento do vírus nos EUA.
A FDA autorizou o remdesivir para uso emergencial em maio, indicando na época que os benefícios do medicamento superavam os riscos potenciais. Ensaios de tratamento feitos em larga escala pela Organização Mundial da Saúde indicaram que o remdesivir tem “pouco ou nenhum efeito” nas taxas de mortalidade de pacientes hospitalizados.
No entanto, a FDA anunciou sua aprovação na quinta-feira (22) para adultos e crianças com mais de 12 anos (desde que atendam a certas restrições de peso) que estão internados por causa do vírus.
“A aprovação de hoje é apoiada por dados de vários ensaios clínicos que a agência avaliou rigorosamente e representa um marco científico importante na pandemia de COVID-19”, disse o comissário da FDA, Stephen M. Hahn, em um comunicado. “Como parte do Programa de Aceleração de Tratamento de Coronavírus da FDA, a agência irá continuar a ajudar a liberar novos produtos médicos para os pacientes o mais rápido possível, enquanto, ao mesmo tempo, determina se eles são eficazes e se seus benefícios superam seus riscos.”
Em sua decisão, a FDA citou dois estudos patrocinados pela Gilead, um dos quais mostrou que tomar remdesivir melhorou ligeiramente os sintomas entre pacientes adultos com COVID-19, embora não por uma taxa estatisticamente significativa, enquanto o outro mostrou que o medicamento não fez muita diferença no geral.
Um terceiro estudo que a agência citou, conduzido pelo Instituto Nacional de Alergia e Doenças Infecciosas dos EUA, descobriu que o remdesivir diminuiu ligeiramente o tempo de recuperação dos pacientes. Portanto, embora esteja longe de ser o tipo de panaceia alardeado no passado para outros tratamentos experimentais, alguns pacientes podem ter benefícios ao tomar o medicamento.
Desenvolvido pela Gilead para tratar o Ebola, o remdesivir atua interrompendo o processo de replicação de um vírus e impedindo que ele se multiplique. A pesquisa mostrou que ele pode ser usado para bloquear a atividade dos coronavírus nas células, e foi considerado eficaz contra outras cepas, como os que causam a MERS e a SARS. O Dr. Anthony Fauci, o maior especialista em doenças infecciosas dos EUA, disse em abril que os testes mostraram que a droga melhorou modestamente os tempos de recuperação de pacientes com COVID-19.
A melhoria “não é um nocaute”, disse Fauci em uma coletiva de imprensa na Casa Branca na época, mas “é uma prova de conceito muito importante, porque demonstra que uma droga pode bloquear este vírus”.
A Gilead continuará conduzindo pesquisas sobre o remdesivir, já que a FDA observa em seu estudo que ainda faltam dados suficientes sobre como a droga afeta crianças menores de 12 anos, pessoas grávidas ou com problemas de saúde subjacentes. Em uma carta aberta publicada na quinta-feira (22), o diretor médico da Gilead disse que a empresa está acelerando a produção e terá doses suficientes para tratar “globalmente todos os pacientes clinicamente apropriados” na próxima semana.
Além dos benefícios limitados nos estudos realizados até o momento, há outras questões envolvendo o remdesivir. O tratamento é caro, podendo chegar a mais de US$ 3 mil nos EUA, e paira a suspeita de que a aprovação foi uma medida tomada tendo em vista a disputa política e as eleições presidenciais de novembro, dado o processo relativamente rápido para a liberação do medicamento.