
Núcleo produzirá células CAR-T que serão usadas contra câncer em ensaio clínico
Texto: Maria Fernanda Ziegler | Agência FAPESP
Aprovado pela Agência Nacional de Vigilância Sanitária (Anvisa) na quarta-feira (27/09), o ensaio clínico com as chamadas células CAR-T para tratamento de câncer no sangue deve iniciar nos próximos meses, com a participação de 81 voluntários ainda não selecionados. Segundo os idealizadores do estudo, trata-se do primeiro passo para transformar o Núcleo de Terapia Avançada (Nutera) – a primeira fábrica de produtos celulares da América Latina inaugurada em 2022 com apoio da FAPESP – em fornecedor de produtos para terapias celulares avançadas, como as células CAR-T, para o Sistema Único de Saúde (SUS).
A terapia com as células CAR-T traz esperanças para pessoas com tipos de câncer de difícil tratamento. A técnica foi testada pela primeira vez na América Latina, em 2019, por pesquisadores do Centro de Terapia Celular (CTC) – um Centro de Pesquisa, Inovação e Difusão (CEPID) da FAPESP sediado na Universidade de São Paulo (USP) de Ribeirão Preto. No total, 17 pacientes já receberam o tratamento de forma experimental no CTC. A maioria apresentou remissão total da doença em um prazo de pouco mais de um mês (leia mais em: agencia.fapesp.br/31656).
Os testes clínicos devem iniciar nos próximos meses com o objetivo de verificar a segurança e a efetividade do tratamento (fase 1 e 2) em pessoas com leucemia linfoide aguda de células B e linfoma não Hodgkin de células B. Porém, como ainda falta a aprovação da Comissão Nacional de Ética em Pesquisa (Conep) para que os testes se iniciem, ainda não foram estabelecidos os perfis desses voluntários.
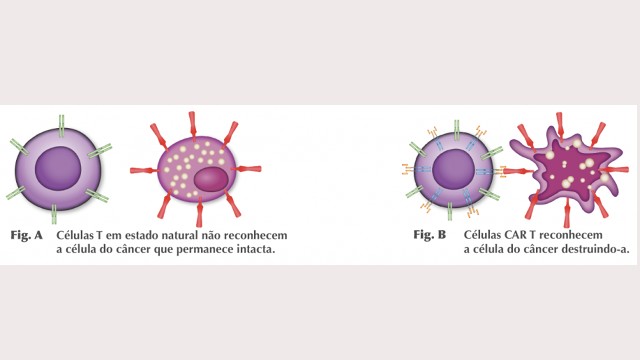
A terapia com as células CAR-T traz esperanças para pessoas com tipos de câncer de difícil tratamento (ilustração: CTC-USP)
A iniciativa será realizada gratuitamente em cinco hospitais do Estado de São Paulo, dentre eles o Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto (FMRP-USP) e o Hospital das Clínicas da Faculdade de Medicina (FM-USP).
“A aprovação dos testes é uma etapa importante para um plano maior: a produção de produtos celulares [células alteradas em laboratório] para o tratamento de diferentes tipos de câncer e de outras doenças. É a primeira vez que produtos dessa complexidade são distribuídos integralmente na América Latina. Trata-se de um avanço enorme para a área de biotecnologia”, destaca Dimas Covas, diretor do Hemocentro de Ribeirão Preto e coordenador da pesquisa.
Isso porque, além de aprovar os testes clínicos, a Anvisa também liberou a produção de produtos celulares para o ensaio. O Hemocentro de Ribeirão Preto, a USP e o Instituto Butantan firmaram uma parceria que resultou na construção do Nutera, que recebeu financiamento por meio do Programa Centros de Ciência para o Desenvolvimento (CCDs) da FAPESP (leia mais em: agencia.fapesp.br/38914).
Só depois dos resultados do estudo, será possível pleitear com a Anvisa a comercialização e distribuição dos produtos celulares.
“A fábrica é uma plataforma que permite manipular células geneticamente modificadas, como é o caso das células CAR-T, vetores virais para a terapia gênica, células derivadas de células-tronco pluripotentes. A fábrica foi construída em uma área pública, em um hospital que atende quase que inteiramente pacientes do SUS. Começamos com o CAR-T19, que é o produto do momento, mas existe um pipeline com muitas pesquisas acontecendo, com a segunda e a terceira geração de produtos CAR-T, por exemplo. Portanto, os ensaios clínicos são só o início de um projeto que vem sendo muito bem-sucedido”, afirma Covas.
Atualmente, a fábrica tem capacidade para atender 13 casos a cada 34 dias. “Ainda não dá conta de toda a demanda do SUS. Mas a nossa expectativa é que, em um ano, seja possível fazer 150 casos e ir escalonando esse número com o tempo”, afirma Diego Clé, diretor médico do Hemocentro de Ribeirão Preto e um dos pesquisadores envolvidos.
Célula por célula
Durante os ensaios clínicos, os linfócitos (células de defesa) dos voluntários serão coletados e as amostras de sangue serão enviadas para a fábrica. Lá, os pesquisadores, por meio de técnicas de bioengenharia, vão colocar uma sequência genética de um vetor viral no DNA desses linfócitos.
Com a nova sequência de DNA, o linfócito passa a expressar uma proteína nova (que os linfócitos não tinham anteriormente), capaz de reconhecer os tumores.
“O linfócito passa a expressar um receptor (o chamado CAR) em sua superfície que reconhece uma proteína específica da célula tumoral. No caso do nosso estudo, o receptor reconhece a proteína CD19, que está presente nas células da leucemia linfoide e do linfoma não Hodgkin”, explica Clé.
Depois de prontos, os linfócitos são congelados e devolvidos para os hospitais onde os ensaios clínicos serão realizados. “O paciente recebe os seus novos linfócitos como se fosse em uma transfusão de sangue. Nesse momento, as células de defesa passam a reconhecer o tumor e a liberar uma série de mediadores inflamatórios para atacá-lo”, diz o médico.
Mais informações em: www.hemocentro.fmrp.usp.br/terapia/.








