Anvisa recebe 30 pedidos de registro de autotestes para Covid
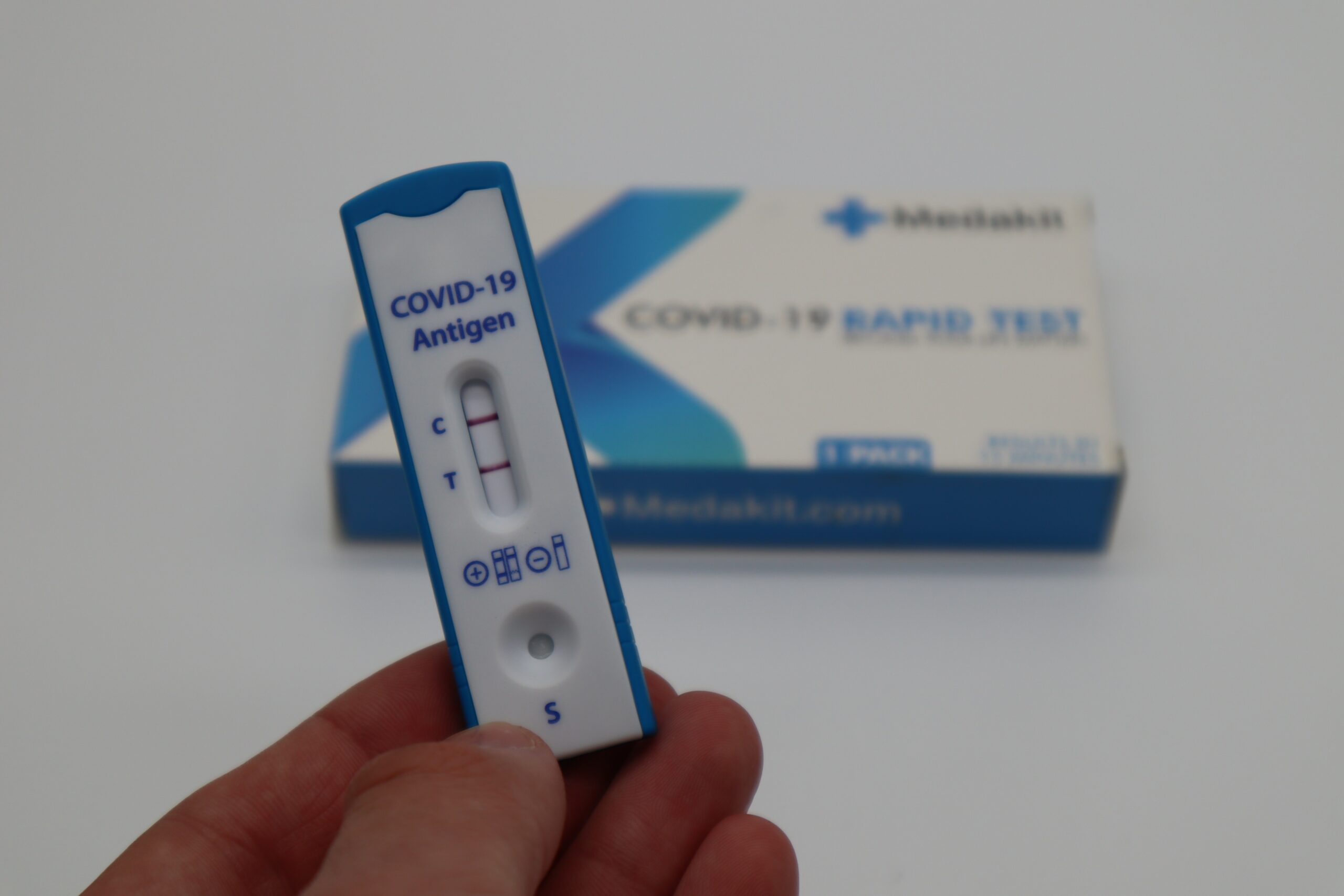
O uso de autotestes para detecção de Covid-19 no Brasil foi liberado pela Anvisa (Agência Nacional de Vigilância Sanitária) na última sexta-feira (28). Mesmo assim, o produto ainda não pode ser encontrado nas farmácias do país, pois nenhuma fabricante recebeu o aval da agência para comercializa-lo.
A expectativa é que isso mude ainda esse mês. Até a última quinta-feira (5), a Anvisa contava com 30 pedidos de registro de autotestes para Covid-19, que podem ser acompanhados neste painel. O quadro, disponibilizado pelo próprio Ministério da Saúde, monitora a entrada de novas solicitações.
Destes, três estão com a análise concluída e esperando publicação no Diário Oficial da União – veículo nacional que torna público assuntos de âmbito federal. Outros dois estão agora em análise, enquanto o restante dos pedidos de registro de autotestes já foi “distribuído para a área responsável”.
A primeira empresa a solicitar o registro da Anvisa foi a Okay Technology Comércio do Brasil Ltda, no dia 31 de janeiro. Seu kit de testagem é importado e a amostra deve ser coletada por um swab nasal – o famoso cotonete. O produto de outras companhias, como a Biosul Produtos Diagnósticos Ltda, utiliza saliva para o exame.
Diversos fatores devem ser considerados pela Anvisa antes da liberação do produto. Entre eles estão a segurança, regularidade da documentação técnica e acessibilidade das instruções de uso – como forma de armazenamento do produto e descarte.
Em paralelo à Anvisa, o Instituto Nacional de Controle de Qualidade em Saúde (INCQS) também faz a análise técnica do produto. Por ser um teste destinado a leigos, é exigido uma sensibilidade e especificidade mínima de 80% e 97%, respectivamente.
O resultado positivo do autoteste não pode ser utilizado como atestado médico para afastamento do trabalho. Na verdade, o exame deve ser considerado como uma triagem, sendo necessário buscar por atendimento médico a depender do resultado.